UNTERSTÜTZUNG BEI IT-VALIDIERUNG
"WENN SIE EINEN SCHEISSPROZES DIGITALISIEREN, DANN HABEN SIE EINEN SCHEIS DIGITALEN PROZESS!" (THORSTEN DIRKS)
Gesetzliche Anforderungen:
Die Leitlinien für die gute Vertriebspraxis von Humanarzneimitteln (Guidelines on Good Distribution Practice of Medicinal Products for Human Use – GDP) fordern, dass bevor ein computergestütztes System in Betrieb genommen wird, durch eine geeignete Validierung oder durch Verifikationsstudien nachgewiesen wird, dass das System in der Lage ist, die gewünschten Ergebnisse genau, kontinuierlich und reproduzierbar zu erreichen.
Das Hauptziel einer Validierung ist es, aufzuzeigen, dass das fragliche System die Funktionalitäten bietet, die spezifiziert werden, und die funktionalen Anforderungen im Sinne einer reproduzierbaren und zuverlässigen Ergebniserzeugung erfüllt sind.
Unter Computergestützten Systemen (CS) versteht man die Kombination von Hardware-Komponenten, Peripheriegeräten und zugehöriger Software, die zur Ausführung spezieller Funktionen entworfen und entsprechend eingerichtet wurden.
Zur Durchführung einer Validierung werden neben den GDP Leitlinien die GAMP5 (Good Automated Manufacturing Practice) herangezogen. Diese Leitlinien beschreiben die Vorgehensweise zur Integration der pharmazeutischen Qualitätsanforderungen an computergestützte Systemen von der Planungs- und Entwicklungsphase über die Installations- und Betriebsphase bis hin zur Stilllegung oder Ablösung.
Was bedeutet das für Sie:
GAMP 5 zielt auf die folgenden Kernkonzepte ab:
– Produkt- und Prozessverständnis entwickeln
– Lebenszyklusansatz im Rahmen des Qualitätsmanagements-Systems verfolgen
– Qualitätssichernde Maßnahmen und Erfahrungen der Lieferanten in Prozesse integrieren
– Risikomanagement über den gesamten Lebenszyklus des IT-Systems betreiben
– Skalierbare Lebenszyklus-Aktivitäten implementieren
Warum EIPL:
Wir erarbeiten zusammen mit Ihnen in themenbezogenen Workshops die Ziele der CS-Validierung in der Pharma-Supply-Chain:
– Den Einfluss der Systeme, mit deren Hilfe Prozesse und Materialflüsse von Arzneimitteln gesteuert und überwacht werden, auf die Produktqualität stets stabil zu halten
– Sicherzustellen, dass Entwicklungsprozesse in der IT den pharmazeutischen Qualitätsanforderungen genügen
– Kritische Stellen in der Computer-System-Validierung (CSV) zu bestimmen
– Datenintegrität, Produktqualität und Patientensicherheit sicherzustellen
– Abläufe durch die Erstellung von Prozessen und Richtlinien klar zu definieren, insbesondere in der Qualitätssicherung und -kontrolle
– Definierte Dokumentationsmethodik (elektr./Papierformat) einzuhalten
– IT-System (Hard- und Software) vor Manipulation durch interne Prozesse zu schützen
– Klare Verantwortlichkeiten festzulegen
– Compliance zu gewährleisten bei gleichzeitiger Kosten- und Zeitersparnis im Betrieb
Am Beispiel der Validierung eines Telematik-Systems fallen unter anderem folgende Schritte an: Spezifikation des Systems (URS), Qualifizierung der Komponenten (physisch), IQ des Gesamtsystems, Abbildung des Geschäfsfalles in Testplänen und Abtesten (kombinierte OQ/PQ).
.
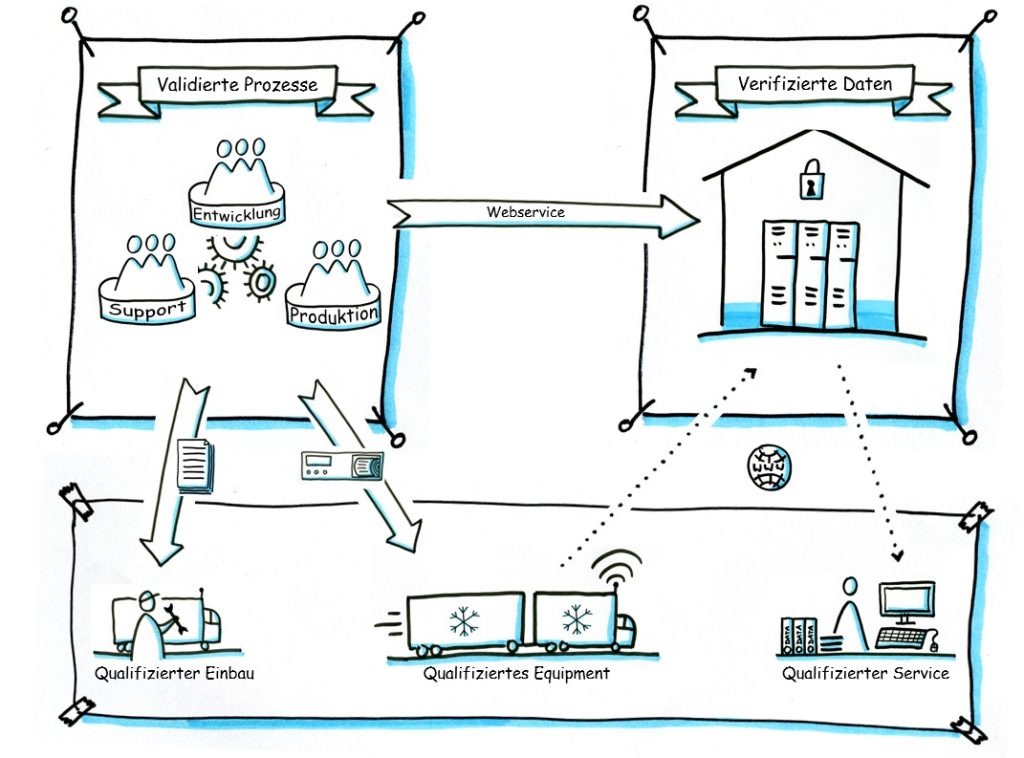
Unsere Experten für die IT-Validierung erörtern mit Ihnen in Audits und Workshops den Umfang der durchzuführenden Maßnahmen.
Sprechen Sie uns an. Wir unterstützen Sie gerne!
Pragmatisches Consulting auf Basis von Fakten… das ist EIPL!



